Diese Phase-II/III-Studie untersucht die Wirksamkeit von Selinexor, einen oralen Inhibitor des Nuclear-Export-Proteins Exportin I bei Patienten mit fortgeschrittenem, nicht operablem dedifferenzierten Liposarkom (DDLS).
Überblick:
| Studienname | SEAL (Selinexor in Advanced Liposarcoma) |
| Erkrankung/Subtyp | Fortgeschrittenes, dedifferenziertes Liposarkom (DDLS) |
| Studienphase | II/III |
| Status | Offen, rekurtiert |
| Sponsor | Karyopharm Therapeutics |
| Geplante Teilnehmerzahl | 334 weltweit |
| Weiterführende Fach-Informationen | https://clinicaltrials.gov/ct2/show/NCT02606461 |
Zusammenfassung für Patienten:
|
Welche Frage untersucht die Studie? |
Ziel der Studie ist es herausfinden, ob das neuartige Medikament Selinexor bei Patienten mit dedifferenziertem Liposarkom und nach mindestens zwei bis fünf vorangegangenen Therapien im Vergleich zu Placobo (Scheinmedikament) wirksam und sicher ist, wenn diese einen Krankheitsfortschritt verzeichnen. |
| Wer kann an der Studie teilnehmen? |
|
| Ist die Studie offen bzw. aktiv? | Ja, die Studie schließt Patienten ein (rekrutiert). |
| Wo wird die Studie durchgeführt? |
Die Studie wird in folgenden Zentren durchgeführt:
Weiterführende Informationen erhalten Sie hier (Englisch): https://clinicaltrials.gov/ct2/show/NCT02606461 |
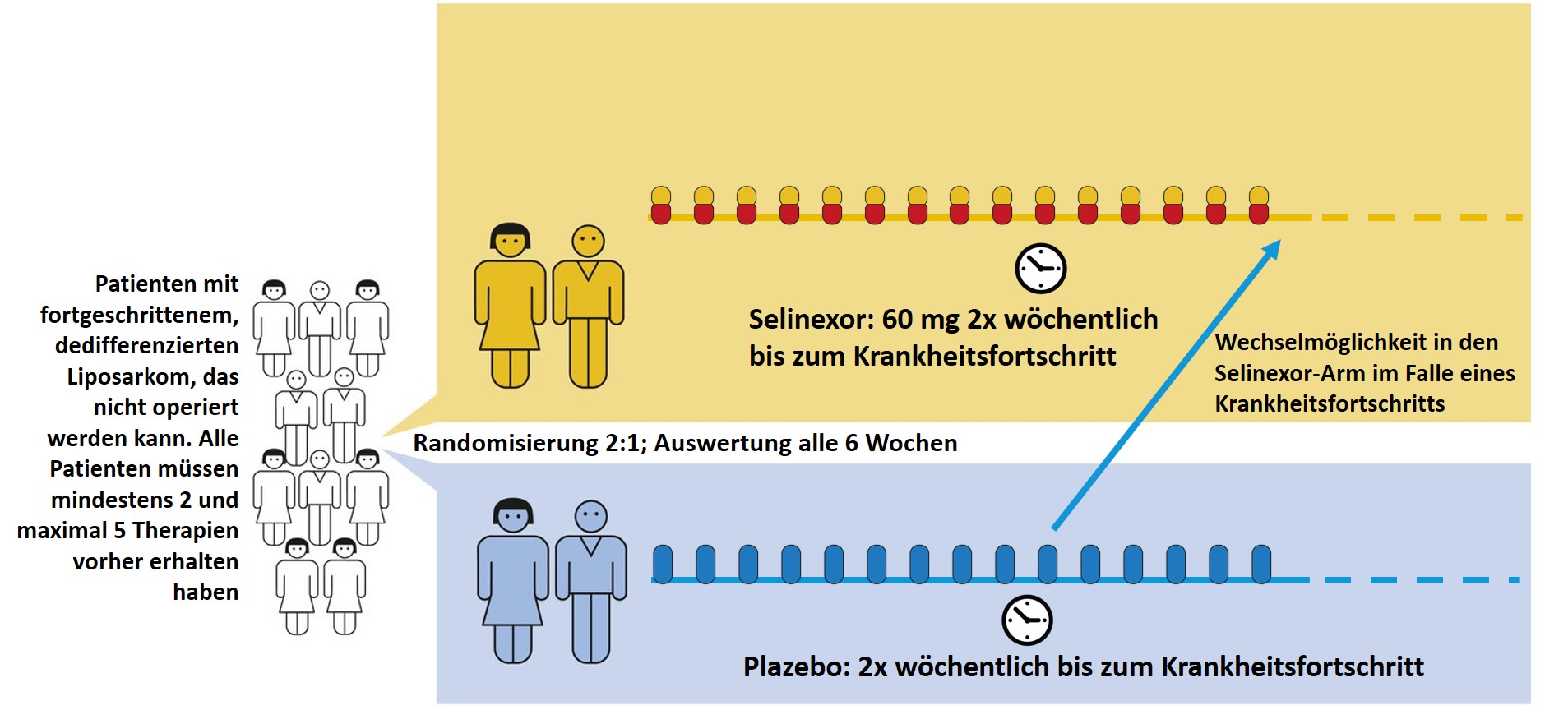
| Wie wird die Studie durchgeführt? |
Diese Studie besteht aus zwei Phasen: Phase II und Phase III. Beide Phasen haben zwei Studienarme (Gruppen): Alle teilnehmenden Patienten werden zufällig (von einem Computer) in diese zwei Gruppen aufgeteilt. In Phase II der Studie erhielt die Hälfte der Teilnehmer Selinexor, die andere Hälfte Placebo. In Phase III erhalten zwei Drittel der Teilnehmer Selinexor, ein Drittel ein Placebo. Patienten, die unter Placebo einen Krankheitsfortschritt verzeichnen, können in den Selinexor-Arm wechseln (Cross-Over). Phase II dieser Studie ist abgeschlossen, Phase III ist nicht abgeschlossen und schließt derzeit Patienten ein. Design der Phase III dieser Studie:
|
Bitte beachten Sie: Dies ist eine patientenfreundliche Zusammenfassung einer klinischen Studie und dient ausschließlich der Informationen. Wir bitten Patienten, sich an ihr behandelndes Sarkom-Zentrum für weiterführende Informationen zu laufenden klinischen Studien zu wenden.